Recherche clinique
Établissement support du Groupement Hospitalier de Territoire, le Centre Hospitalier de Mâcon s’engage au quotidien dans la recherche clinique. Ces projets de recherches sont proposés aux patients afin d’améliorer continuellement les soins dispensés dans notre structure et pour développer les connaissances des pathologies, leur mode de déclenchement (physiopathologie), en accélérer le diagnostic et optimiser le traitement.
Elle permet aux patients de bénéficier de traitements innovants et contribue à promouvoir l’excellence scientifique des secteurs de santé.
Histoire de la recherche au Centre Hospitalier de Mâcon
Depuis de nombreuses années, encouragé par les plans nationaux de recherche, le Centre Hospitalier de Mâcon est investi dans la Recherche Biomédicale.
Des essais cliniques sont réalisés depuis plus d’une dizaine d’années dans tous les domaines de la santé hospitalière (cancérologie, hématologie, cardiologie, pneumologie, néphrologie, pédiatrie…).
Depuis 2022, notre Centre Hospitalier a mis en place une convention de Recherche avec le CHU de Dijon et le Centre Hospitalier d’Auxerre au sein d’une entité dénommée « Recherche Clinique en Bourgogne » permettant de développer la recherche clinique promue par le CHU de Dijon sur le territoire Bourguignon.
En 2023, le Centre Hospitalier de Mâcon a également adhéré au Réseau de Recherche et Innovation en Centre Hospitalier (RICH) dont l’objectif est de promouvoir et soutenir la recherche et l’innovation en santé dans les centres hospitaliers hors CHU.
Le Centre Hospitalier est également partenaire de l’Association de Recherche Médicale en Saône-et-Loire qui promeut le développement et la valorisation des initiatives de recherche en lien avec la santé sur le territoire de la Saône-et-Loire.
Qu’est-ce que la recherche clinique ?
Principes généraux
La recherche clinique permet d’apporter de nouvelles connaissances sur le fonctionnement de l’organisme normal, sur la compréhension des maladies, leur prévention, leur diagnostic et leur traitement.
Il s’agit d’un prérequis indispensable avant la généralisation à l’ensemble de la population d’une nouveauté médicale. Les plus grands progrès scientifiques sont tous issus d’essais en recherche clinique.
Elle est réalisée chez l’être humain, chez des personnes systématiquement volontaires et après expérimentation en recherche fondamentale ou animale.
Pour assurer la validité d’un résultat scientifique, la recherche médicale s’effectue dans un cadre rigoureusement organisé et codifié appelé « protocole ». Le protocole définit les règles imposées à l’ensemble des praticiens participant à la recherche.
Comment est-elle realisée ?
Les promoteurs proposent leurs projets scientifiques aux différents centres (dont le CH de Mâcon) au niveau régional, national ou international afin d’obtenir le nombre de patients suffisants pour pouvoir prouver l’hypothèse scientifique.
Ces études scientifiques sont régies par la Loi Jardé qui définit les Recherche Impliquant la Personne Humaine (RIPH) comme des recherches sur des personnes volontaires saines ou malades.
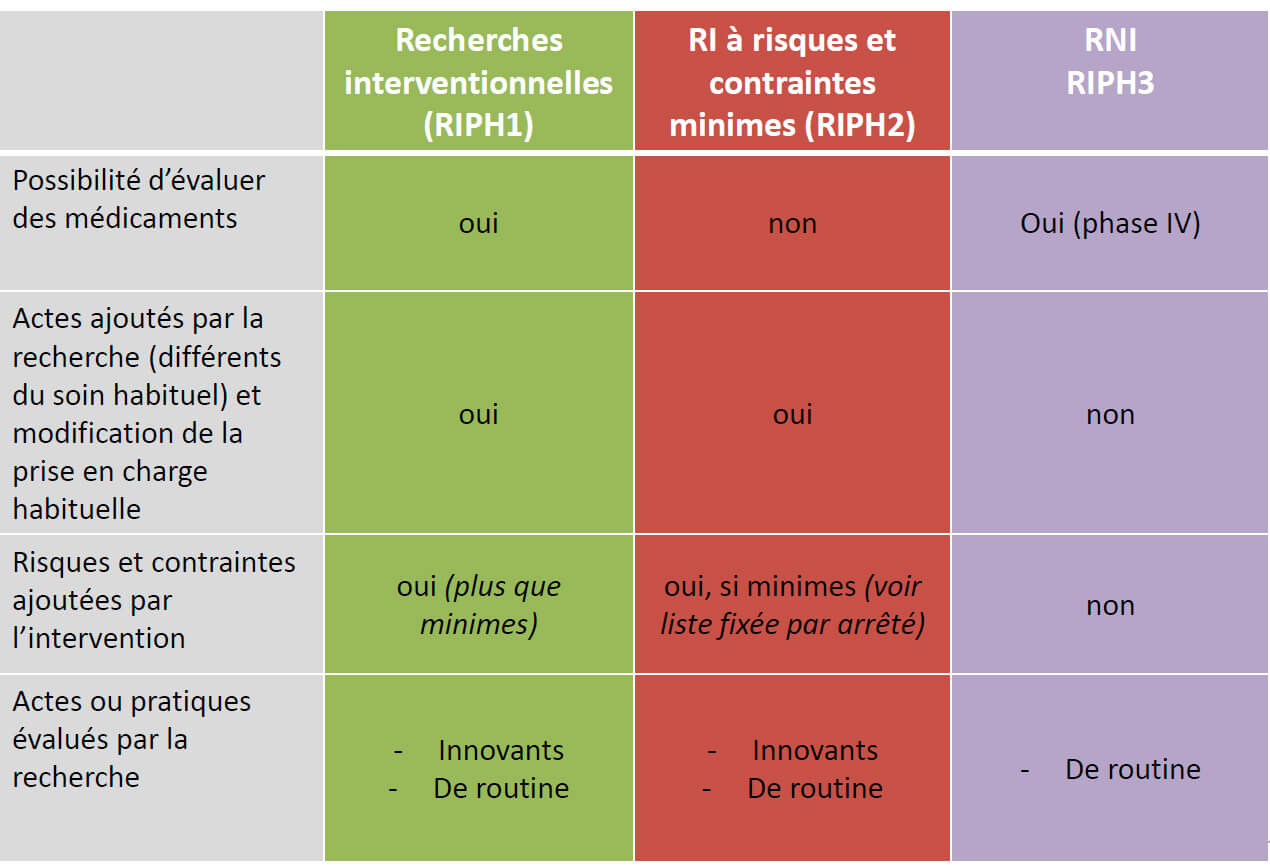
Les Recherches Impliquant la Personne Humaine sont divisées en trois catégories :
RIPH 1 (interventionnelle, dite « à risque ») :
Études interventionnelles modifiant la pratique des soins courants de façon « importante » et/ou avec des risques élevés pour les participants, étude impliquant les nouveaux médicaments le plus souvent. Seul un médecin thésé (ou une sage-femme pour les études portant sur des traitements, actes qu’elle est habilitée à réaliser) peut inclure les patients dans cette catégorie d’étude. Cette catégorie bénéficie d’un cadre réglementaire lourd dont l’objectif final est la protection des patients (consentement du patient, accord d’une Direction de Recherche Clinique et d’Innovation, avis favorable d’un Comité de Protection des Personnes, autorisation de l’ANSM, enregistrement sur la plateforme clinicaltrials.gov, autorisation de recherche auprès de la CNIL si elles ne rentrent pas dans une des méthodologies de référence, enregistrement dans une liste tenue par le Délégué à la Protection des données).
Exemple : Étude sur plusieurs centres, en aveugle, évaluant l’efficacité et la sécurité d’un médicament, d’un vaccin ou d’un dispositif médical chez des patients sains ou dans le cadre de maladies.
RIPH 2 (peu interventionnelle, dite « à faible risque ») :
Recherches interventionnelles ne portant ni sur des médicaments, ni sur des Dispositifs Médicaux et qui ne comportent que les risques et contraintes minimes (cf. Liste ci-dessous). Seul un médecin thésé ou une personne « qualifiée » peut inclure les patients dans cette catégorie d’étude.
Cette catégorie bénéficie d’un cadre réglementaire également important pour protéger le patient (consentement du patient, accord d’une Direction de Recherche Clinique et d’Innovation, avis favorable d’un Comité de Protection des Personnes, autorisation de l’ANSM, enregistrement sur la plateforme clinicaltrials.gov, autorisation de recherche auprès de la CNIL si elles ne rentrent pas dans une des méthodologies de référence, enregistrement dans une liste tenue par le Délégué à la Protection des données).
Exemple : Étude sur l’évaluation de l’intérêt d’un nouveau biomarqueur dans le cadre d’une pathologie particulière.
RIPH 3 (peu ou pas interventionnelle, « sans risque ») :
Recherches non interventionnelles ou les actes et produits sont utilisés de manière habituelle sans procédure supplémentaire ou inhabituelle de diagnostic, traitement ou surveillance. Un médecin thésé ou une personne « qualifiée » (tel qu’un interne) peut inclure les patients dans cette catégorie d’étude.
Cette catégorie bénéficie d’un cadre réglementaire plus léger (notice d’information au patient, avis favorable d’un Comité de Protection des Personnes, autorisation de l’ANSM, enregistrement sur la plateforme clinicaltrials.gov, et un enregistrement dans une liste tenue par le Délégué à la Protection des données).
Exemple : Étude sur l’évaluation par un questionnaire prospectif des préférences des patients vis-à-vis des résultats d’un traitement pour l’arthrose.
Hors RIPH (non interventionnelles) :
Rétrospectives, organisées et pratiquées sur des personnes saines ou malades, visant également à évaluer des modalités d’enseignement ou d’exercice des professionnels de santé ou visant l’évaluation dans le domaine de santé à partir de l’exploitation de données déjà recueillies.
Ces recherches nécessitent une notice d’information au patient, un enregistrement sur la plateforme clinicaltrials.gov, un enregistrement dans une liste tenue par le Délégué à la Protection des données et une autorisation CNIL si elles ne rentrent pas dans une des méthodologies de référence.
Exemple : Étude sur l’évaluation des pratiques professionnelles sur l’usage d’un traitement antibiotique dans le cadre d’une infection pulmonaire.
La recherche est toujours réalisée sur des personnes volontaires.
Concernant les études relevant de la RIPH :
- Le praticien vous propose de participer à une recherche (si elle correspond à votre situation) et vous présente l’étude oralement et par écrit.
- Après un délai de réflexion et obtenu des réponses à vos questions, vous êtes libre d’accepter ou refuser.
- Vous décidez librement de signer un consentement libre et éclairé ou un formulaire de non opposition (selon le type de l’étude).
- Vous avez la possibilité à tout moment de retirer votre participation sans la moindre conséquence sur la qualité de votre prise en charge.
Concernant les études ne relevant pas de la RIPH (Hors RIPH) :
- Une note d’information vous est envoyée ou remise en main propre pour vous expliquer les modalités de l’étude.
- Vous avez la possibilité de vous opposer à l’utilisation de vos données via cette note d’information ou en contactant l’unité de recherche ou le délégué de la protection des données.
Par ailleurs, le praticien peut également vous orienter vers un autre établissement, dans lequel se déroule un projet de recherche dont vous pourriez tirer un bénéfice.
L’information que l’on doit vous délivrer :
- L’objectif de la recherche
- La durée de votre participation
- Le calendrier du suivi (consultations, examens,…)
- Les éventuels bénéfices attendus
- Les risques
- Les contraintes liées à votre participation
- Les alternatives si vous ne participez pas à la recherche
Principaux acteurs de la recherche
- L’investigateur / Co-investigateur : c’est le médecin qui vous prend en charge, il vous a présenté l’étude clinique. Il est aidé par l’attachée de recherche clinique ou technicien d’étude clinique pour recueillir les données de la recherche.
- L’ARC ou TEC : personne qui complètera les données anonymisées nécessaire pour la recherche en collaboration avec l’investigateur, pourra effectuer certains examens…
- Le promoteur : Le promoteur est à l’initiative du projet de recherche (sociétés savantes, universités, institutions scientifiques, promoteurs industriels des médicaments ou dispositifs médicaux). Le promoteur doit obtenir les autorisations nécessaires à la réalisation du protocole de recherche.
La protection de vos données personnelles
Tous les participants à une recherche biomédicale sont protégés par la loi de santé publique du 9 aout 2004.
- Votre dossier médical reste confidentiel
- Les professionnels qui consultent votre dossier sont soumis au secret professionnel
- Dans le cadre de la recherche vos données sont systématiquement anonymisées.
Pour toute question relative à la protection de vos données, vous pouvez contacter : dpo@ch-macon.fr
Projets de recherche actuellement en cours au centre hospitalier de mâcon
De nombreuses études sont actuellement en cours au Centre Hospitalier de Mâcon dans les spécialités suivantes :
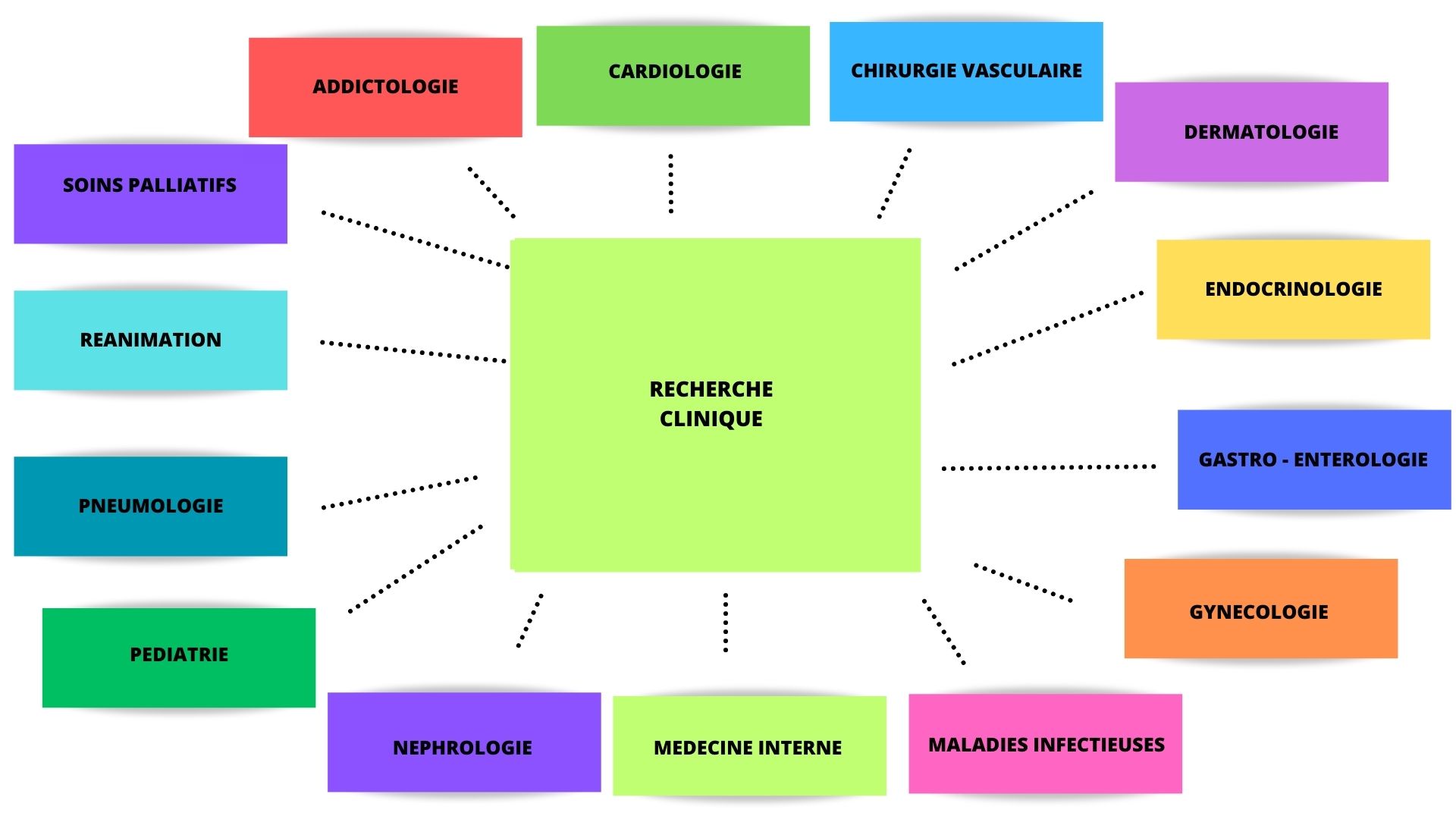
Si vous êtes patient au Centre Hospitalier de Mâcon et que vous souhaitez bénéficier de la Recherche Médicale, vous pouvez vous rapprocher de votre médecin référent de spécialité.
Contacts de l’équipe de recherche clinique
- Dr Thibault MAILLET : coordinateur de l’unité de recherche clinique, médecin spécialiste en médecine interne
- Mme Laetitia MARCHAND : attachée de recherche clinique / infirmière
Pour en savoir +
Liens et téléchargements
Partenaires
Le Centre Hospitalier de Mâcon est partenaire à l’échelle locale et nationale de plusieurs acteurs majeurs :






